1.ZWIĄZKI CHEMICZNE
↓ ↓
ORGANICZNE NIEORGANICZNE
nie zawierają atomów węgla oprócz substancje, których głównym składnikiem dwutlenku węgla i kwasów węglowych węgiel. Są złożone i należą do nich, np.
oraz jego soli. Najważniejsze występujące cukier i białka.
w organizmie to woda i sole mineralne.
↓
2. PIERWIASTKI
↓ ↓
MAKROELEMEMTY MIKROELEMENTY
⬆ 0,01% ⬇ 0,01%
| PIERWIASTKI BIOGENNE |Fe, Cu, Zn, Mn, F, I
wchodzą w skład związków organicznych
budujących wszystkie organizmy
C, H, O, N, S, P
|POZOSTAŁE
Ca, Mg, K, Na
Węgiel ma kluczowe znaczenie dla istnienia życia na Ziemi, ponieważ jego atomy mogą tworzyć ze sobą stabilne wiązania, dzięki czemu powstają proste lub rozgałęzione łańcuchy.
Atomy węgla mogą również tworzyć stabilnie wiązania z atomami wodoru, tlenu i azotu. Stanowią wtedy podstawę budowy związków będących w każdej komórce.
Łączenie ze sobą tych pierwiastków powoduje powstawanie grup funkcyjnych:
- hydroksylowa ( -OH )
- karboksylowa ( -COOH )
- aminowa ( -NH2 )
- aldehydowa ( -CHO )
- ketonowa ( -CO )
Niedobór w.w. pierwiastków występuje w sytuacjach głodu i odwodnienia.
Siarka jest składnikiem cysteiny i metioniny- aminokwasów budujących białka. Umożliwia ona tworzenie dodatkowych wiązań odpowiedzialnych za utrzymywanie struktury białka.
Fosfor występuje w kwasach nukleinowych i niektórych lipidach ( tłuszcze ), stanowiących budulec błon komórkowych. Buduje też kości i zęby.
ZNACZENIE WYBRANYCH MAKRO- I MIKROELEMENTÓW
⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇⬇
MAKROELEMENTY
WAPŃ - składnik szkieletów kręgowców i bezkręgowców
- wpływa na skurcze mięśni
- bierze udział w procesie krzepnięcia krwi
NIEDOBÓR MAGNEZU
człowiek i zwierzęta:
- krzywica u dzieci
- osteoporoza u dorosłych
- próchnica zębów
- drgawki
- krzepnięcie krwi
- nieprawidłowy wzrost
- zakłócenia gospodarki wodnej
MAGNEZ - składnik kości
- aktywator enzymów
- składnik chlorofilu
- niezbędny do uzyskiwania energii z ATP
NIEDOBÓR MAGNEZU
człowiek i zwierzęta:
- kurcze i drżenie mięśni
- zaburzenie pracy serca
- zahamowanie fotosyntezy
- chloroza, czyli żółknięcie
- więdnienie
POTAS- bierze udział w przewodzeniu impulsów nerwowych
- jest ważnym składnikiem ustrojowym u zwierząt
- wpływa na skurcze mięśni
- aktywator wielu enzymów
NIEDOBÓR POTASU
człowiek i zwierzęta:
- osłabienie pracy mięśni
- zaburzenie rytmu pracy serca
rośliny:
- zółknięcie liści
- więdnięcie
- brak wzrostu
SÓD- bierze udział w przewodzeniu impulsów nerwowych
- u zwierząt jest ważnym składnikiem płynów ustrojowych
NIEDOBÓR SODU
człowiek i zwierzęta:
- utrata pobudliwości nerwowych
MIKROELEMENTY
ŻELAZO- jest składnikiem białek złożonych transportujących lub magazynujących tlen
- wchodzi w skład enzymów uczestniczących w oddychaniu i fotosyntezie
NIEDOBÓR ŻELAZA
człowiek i zwierzęta:
- anemia
- zaburzenia rytmu pracy serca
- zakłocenie oddychania
- zakłócenie fotosyntezy
- żółknięcie liści
JOD- składnik hormonów tarczycy regulujących, np. pracę serca, przemianę materii
NIEDOBÓR JODU:
człowiek i zwierzęta:
- powiększenie tarczycy
- obrzęki skóry
- niedorozwój umysłowy
3. RODZAJE WIĄZAŃ I ODDZIAŁYWAŃ CHEMICZNYCH
Atomy jednego lub kilku pierwiastków mogą łączyć się ze sobą za pomocą różnych wiązań chemicznych. Tworzą się one głównie dzięki elektronom walencyjnym. Elektrony te są najsłabiej przyciągane przez jądro, ponieważ znajdują się na najbardziej zewnętrznej powłoce elektronowej atomu.
Każde wiązanie chemiczne ma pewną energię, której miarą jest ilość energii potrzebna do jego rozerwania.
Wiązania silne odznaczają się energią wynoszącą od kilkudziesięciu do kilkuset kJ/mol.
W zależności od stopnia oddziaływania wyróżnia się wiązania:
· kowalencyjne
· jonowe
· wodorowe
· siły van der Waalsa
· oddziaływania hydrofobowe
Wiązania kowalencyjne
(atomowe) to wiązanie silne, które powstaje przez uwspólnienie jednej lub kilku par elektronów należących do różnych atomów. Taki typ wiązania spotyka się np. w cząsteczkach wodoru, tlenu, chloru , azotu, a także między atomami węgla w związkach organicznych. Atomy tych pierwiastków mają wspólną parę lub pary elektronów, które tworzą wiązanie.
Powstawanie wiązania kowalencyjnego
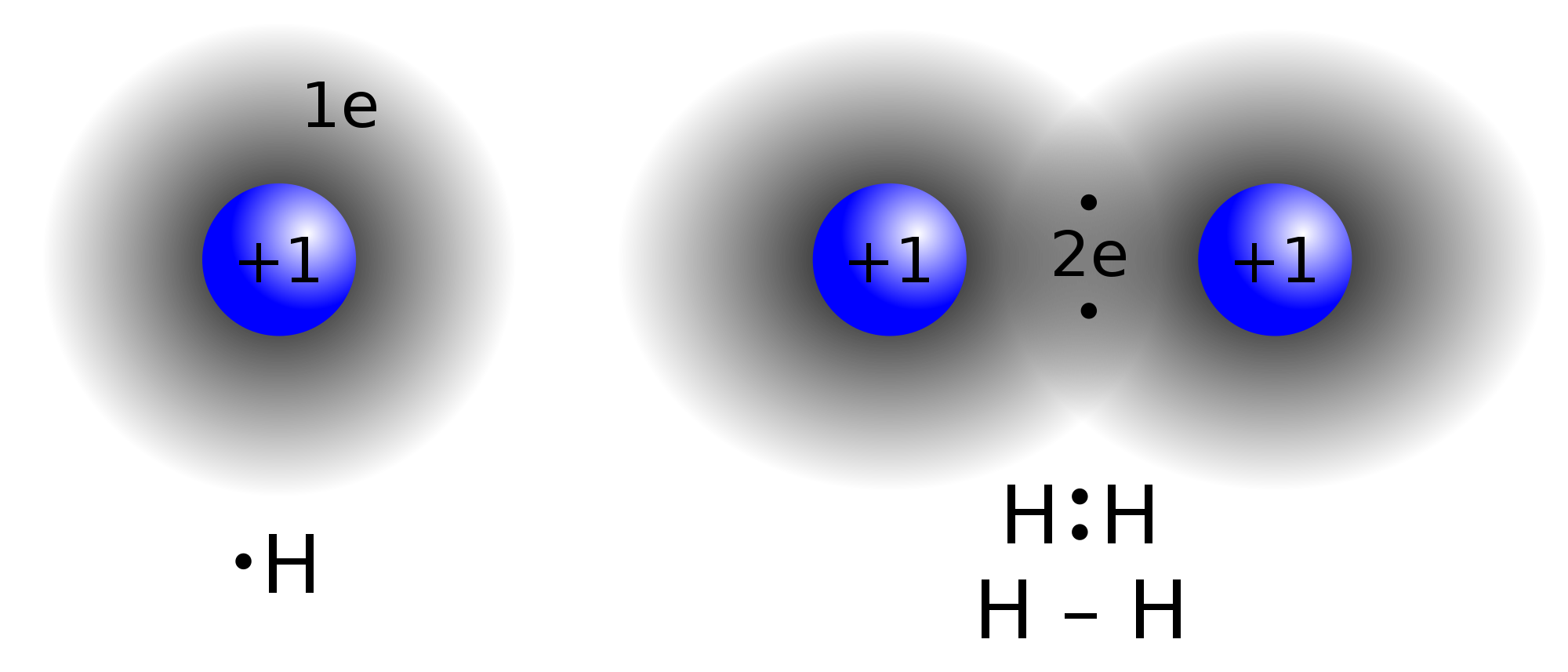
wiązanie kowalencyjne utworzone przez jedną wspólną parę elektronów
(np. w cząsteczce wodoru) to wiązanie pojedyncze, natomiast zbudowane
z dwóch wspólnych par elektronów (np. w cząsteczce tlenu)- podwójne.
Wiązanie kowalencyjne niepolarne
to wiązanie kowalencyjne, w którym- ze względu na podobną siłę przyciąganie elektronów przez atomy budujące cząsteczkę- rozmieszczenie wspólnej pary elektronów jest równomierne.
Wiązanie kowalencyjne spolaryzowane
to wiązanie , w którym wspólna para elektronów jest przesunięta w kierunku jednego z atomów tworzących wiązanie. Cząsteczka związku chemicznego zyskuje w nim charakter dwubiegunowy (polarny) lub, inaczej mówiąc, staje się dipolem. Tego typu wiązanie znajduje się np. w cząsteczce wody. Atom, który silniej przyciąga wspólną parę elektronów, stanowi biegun ujemny cząsteczki ( w cząsteczce wody jest to tlen), a atom przyciągający słabiej- biegun dodatni ( atomy wodoru). Polarność lub brak polarności cząsteczki wpływa na jej właściwości biologiczne.
Wiązanie kowalencyjne spolaryzowane występuje w cząsteczce wody. Duża siła przyciągania
atomu tlenu powoduje, że wspołne pary elektronów są wyraźnie przesunięte w jego kierunku.
Wiązanie jonowe
powstaje w wyniku przyciągania się różnoimiennych jonów ( jest zatem rodzajem oddziaływania elektrostatycznego). Podobnie jak wiązanie atomowe należy do silnych wiązań chemicznych. Jonem staje się atom, który, dążąc do wypełnienia zewnętrznych powłok elektronowych przyjął lub oddał elektrony. Atomy o ładunku dodatnim (kationy) powstają w wyniku utraty elektronów, natomiast atomy o ładunku ujemnym (aniony) tworzą się przez przyłączenie dodatkowych elektronów pochodzących z innych atomów. W komórce wiązania jonowe nie występują ze względu na panujące w niej środowisko wodne. Cząsteczki wody otaczają bowiem jony tworzące związek i osłabiają ich wzajemne przyciąganie. Środowisko wodne nie eliminuje jednak całkowicie innych oddziaływań elektrostatycznych
W wiązaniu jonowym różnoimienne jony sodu (Na+) i chloru (Cl-) przyciągają się, tworząc cząsteczkę związku chemicznego- chlorku sodu (NaCl)
Wiązanie wodorowe
powstaje między dodatnio naładowanym atomem wodoru jednej cząsteczki a innym atomem naładowanym ujemnie (najczęściej tlenem lub azotem) pochodzącym z innej cząsteczki. Pojedyncze wiązania wodorowe należą do słanych (są ok.10-20 razy słabsze od typowych wiązań kowalencyjnych). Zwykle jednak występują w dużej liczbie, co sprawia, że decydują o właściwościach wielu związków ( np. o wartości temp. topnienia) oraz odgrywają ważną rolę w utrzymywaniu odpowiedniej struktury substancji wielkocząsteczkowych ( np. białek i kwasów nukleinowych). Wiązania wodorowe powstają również między atomami wodoru i tlenu należącymi do różnych cząsteczek wody. Są one odpowiedzialne za szczególne właściwości wody tj. wysoka temperatura topnienia i wrzenia, duże ciepło właściwe, duże napięcie powierzchniowe. W kryształach lodu każda cząsteczka wody jest połączona za pomocą wiązań wodorowych z czterema sąsiadującymi cząsteczkami, tworząc przestrzenną sieć. Podczas topnienia lodu część tych wiązań zostaje rozerwana.
Wiązanie wodorowe między cząsteczkami wody powstaje wskutek przyciągania się atomu tlenu, który
ma ładunek ujemny, z atomem wodoru, który ma ładunek dodatni.
Siły van der Waalsa
to oddziaływania międzycząsteczkowe kilkadziesiąt razy słabsze od wiązań wodorowych. Dlatego dopiero duża ich liczba ma istotny wpływ na kształtowanie się struktury dużych cząsteczek, np. białek. Występowanie sił van der Waalsa jest uwarunkowane dwubiegunową budową cząsteczek oraz przyciąganiem się dipoli położonych blisko siebie.
Oddziaływania hydrofobowe
należą do oddziaływań międzycząsteczkowych. Powstają wtedy, gdy w środowisku wodnym znajdują się cząsteczki, które nie są dipolami. Należą do nich m.in. cząsteczki tłuszczów, układające się w środowisku wodnym tak, aby ich kontakt z wodą był jak najmniejszy (tworząc krople lub warstwę). Oddziaływania hydrofobowe mają zasadnicze znaczenie podczas tworzenia się błon biologicznych.
4. WODA
BUDOWA CZĄSTECZKI WODY
Cząsteczka wody ma budowę polarną, co znaczy, że cząsteczka tlenu ma ładunek ujemny, natomiast cząsteczki wodoru - dodatni.
WŁAŚCIWOŚCI
Uniwersalny rozpuszczalnik
Nie jest ona rozpuszczalnikiem uniwersalnym, który rozpuszcza wszystko. Słabo rozpuszcza substancje pochodzenia organicznego, natomiast bardzo dobrze substancje w których występuje wiązanie jonowe.
Duże napięcie powierzchniowe
zjawisko powstania "cienkiej błony" na powierzchni wody. Woda ma zdolność do kohezji (spójności), czyli przyciągania międzycząsteczkowego; oraz do adhezji, czyli przylegania do substancji zawierających grupy naładowanych atomów lub cząsteczek i zwilżania ich.
Gęstość mniejsza w stanie stałym niż w stanie ciekłym
woda największą gęstość uzyskuje w temp. 4C (1g/cm3) wraz se spadkiem temperatury jej hęstosc maleje, a objetość wzrasta, dlatego lód jest lżejszy od wody i się na niej utrzymuje.
Wysokie ciepło parowania
dzięki tej właściwości woda pełni funkcję termoregulacji (pot). Jednocześnie woda jest dobrym przewodnikiem ciepła łatwo je rozprowadza, dzikęi czemu szybko wyrównuje temperaturę organizmu.
Duże ciepło właściwe
oznacza to, że aby podnieść temperaturę wody, należy jej dostarczyć dużą ilość energii cieplnej, natomiast, żeby obniżyć temperaturę, należy to ciepło odebrać. Dzięki temu woda chroni organizm przed nagłymi zmianami temperatury otoczenia.
5. SOLE MINERALNE
Funkcje:
* są materiałem budulcowym ( zębów , skóry , kości oraz włosów)
* wchodzą w skład: hemoglobiny, mioglobiny, tyroksyny, witaminy B12, ATP, ADP,
enzymów
* stanowią podstawę w gospodarce wodno - elektrolitowej
* odgrywają podstawową rolę w utrzymaniu równowagi kwasowo-zasadowej
* są podwaliną pobudliwości nerwowo-mięśniowej
Brak komentarzy:
Prześlij komentarz